病毒转染(转导transduction)
TLDR:几种常说的病毒载体(逆转录病毒,慢病毒,腺病毒,腺相关病毒)其结构、原理和特点
逆转录病毒
逆转录病毒始于1983年,基于莫洛尼鼠白血病病毒(Mo)MLV改造而来[^1],尽管之前也有类似的研究将病毒用于基因的表达,但这次的研究将逆转录病毒作为一种通用载体改造出来,使之成为最经典病毒载体结构之一。
结构
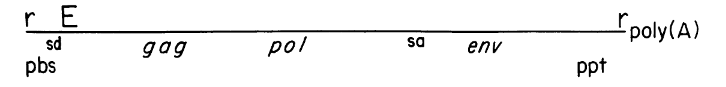
同大部分逆转录病毒一样,MLV的遗传基因包含gag、pol、env三大功能部分和LTR序列[^2]。
具体上,其逆转录的DNA包含:
- LTR:长末端重复序列
- attL,attR:附着序列
- PBS:引物结合位点
- E:封装序列(识别序列)
- gag、pol、env基因
- sd:剪切供体序列
- sa:剪切受体序列
- PPT:多聚嘌呤序列,反转录酶(RT)合成正链DNA的起始点
- 3’ RNA processing site:3‘RNA加工位点
RNA序列:
- E是病毒包装的识别序列,不参加翻译。现在似乎叫$\psi$序列或直接叫包装序列
- 编码基因蛋白:
- gag:内部病毒颗粒的结构蛋白
- pol:先被翻译为gag-pol融合蛋白的一部分,后续翻译后裂解加工产生各种病毒酶:逆转录转酶、整合酶等
- env:RNA剪接后翻译,之后再裂解加工,得到病毒体包膜糖蛋白和(在不同的逆转录病毒种类中不同)跨膜蛋白或第二糖蛋白
原理
人们发现,病毒的包装识别序列和功能序列是分开的,这为病毒的工程化改造提供了机会[^2]:将原病毒的包装序列删去,病毒便无法组装;此时若再将另一段RNA带上包装序列,病毒就会将这段RNA当成自己包装起来,并且会将基因插入到后续感染的细胞中,全然不知自己封的还珠格格是小燕子,而真正的亲生骨肉是紫薇
辅助细胞系
在这段过程中,病毒材料和表达的场所就是辅助细胞(helper cell),可以通过病毒侵染永生化/转染病毒质粒的方式构建,由于病毒遗传物质全被留在辅助细胞中,工程化的病毒载体不会在目的细胞系中继续增殖下去,因而比较安全。已经阉过了(悲)。 对于逆转录病毒,有很多辅助细胞已经被构建成了细胞系(如platE,Phoenix-gp等),在需要时只用将目的基因质粒转入即可产生病毒。
包膜
由于天然病毒感染基本都只针对特定靶标,为了增加目的细胞的广泛性,人们改造了MLV的包膜基因env使之假型化(Pseudotyping)[^3]。
最常用的包膜是VSV-G,其可与细胞表面的磷脂酰丝氨酸和低密度脂蛋白受体 (LDLR) 结合,从而内吞进入细胞,由于LDLR在大多数细胞中都表达,因此为病毒提供了广泛的趋向性;此外,VSV-G可以保护病毒,使得病毒可以在较高速下离心,从而富集病毒来提高滴度;在很多病毒递送载体的改造中,人们也大多用VSV-G为基础,再加上一些膜蛋白来赋予病毒载体更多特性。
慢病毒
慢病毒基于艾滋病病毒HIV改造而来(这不也是逆转录病毒吗QWQ),由于现在在基因递送中被广泛使用而名扬天下,以至于被单独给予了席位。293T+pLxxx,我不说这是谁的日常(泪目),作者不语,只是丢下protocol[^4]。
作为商业化最广的工具之一,慢病毒已经迭代一二三了。常用的二三代比较,二代需要质粒更少(3个),因此转染包装效率会更好,三代质粒多,但因此也使得病毒序列更分散,减小了基因重组导致病毒一家团聚的概率,因而更安全。是命,是这不公平的命让我来的!
一样的gag-pol,一样的VSV-G,为什么就你混的好?怨就怨在MLV只能转染分裂细胞,对于不进行有丝分离的细胞无法,MLV无法将基因组插进去,而慢病毒没有这种限制,而且二三代改进了安全性+转染效率,你MLV有的我有,你MLV没有的,我还是有~。
腺病毒
腺病毒adv最早在人类腺样体中被发现,在人类中,已发现50多种血清型可引起疾病,从轻度呼吸道感染到危及生命的多器官疾病。但实验室选用的adv(Ad5)不会引发肿瘤或其他严重症状,仅产生一些轻度的呼吸道症状,因此被用作一种更安全的用于体内的表达载体。
结构
腺病毒[^5]基因组是线性的 36 Kb 双链 DNA (dsDNA) 分子,包含多个高度剪接的转录本,分为分为早期 (E1-4) 和晚期 (L1-5),基因组两端是反向重复序列ITR。重组的腺病毒删除了E1和E3,其中E1本身在293中表达(你问为什么?293本来就是腺病毒诱导永生的细胞系),E3负责免疫逃避,是个坏人,因此删了这两个基因更安全。
特点
腺病毒感染的目的细胞范围很窄,因为腺病毒没有包膜,只能感染柯萨奇腺病毒受体 (CAR,不是那个嵌合抗原受体CAR啊喂)的细胞
腺病毒不会将自身基因整合到细胞基因组,因此被转染的细胞表达基因是瞬时的
腺病毒属于溶原型,在包装后细胞会破裂,与之对比,MLV和慢病毒都是出芽型
腺病毒免疫原性很高,进人体大多是被杀的份,综合以上特点,腺病毒更适合用来做疫苗,比如熟知的新冠腺病毒疫苗(梦回高中课堂)
腺相关病毒AAV
压轴大佬出现!腺相关病毒[^6]最初是作为腺病毒制剂的污染物被发现的,也因此得名,它是一种二十面体、无包膜的病毒,携带一个大约 4.7 kb 的小单链基因组。
腺相关病毒并不是病毒,而是一种亚病毒因子——卫星病毒,这些家伙只有病毒的部分序列,另一部分需要依靠其他病毒,因此在自然中只能跟其他病毒一起感染,AAV正如其名,需要蹭腺病毒的 E1、E4、E2a 和 VA基因才能复制,就像是天然的病毒载体一样。(人类刚发现的bug,进去一看发现AAV已经用了几万年了)
结构
REP基因负责复制,CAP基因负责编码衣壳蛋白,这决定了AAV的血清型及其偏好。制作工程质粒只需要把其中的REP-CAP分出来即可,在加上其本身需要的协助基因,就能用于包装和转染了
特点
AAV[^7]最厉害的一点在于低免疫原性,由于其一直跟随其他病毒感染,相当于狗腿子,并且抗原序列变化快,人体免疫系统几乎不搭理它,这使得AAV非常适合体内基因递送,在基因治疗中成为了大热门。然而凡事也有例外,在临床上有突然被免疫系统识别引发大范围免疫反应并且致死的案例,使得现在人们对AAV的使用一直加着一层小心
AAV没有包膜,因此需要靠血清型CAP来决定靶向,但这并不完全是一种缺点,因为这也为体内的递送提供了很好的靶向性特点,与之对比,VSV-G既会导致细胞融合又缺乏良好靶向性
但是——目前最要命的一点——AAV载体容量有限,以至于不能携带一个完整的CRISPR,成为现在基因治疗的困难之一,所以现在新的简化CRISPR系统开发了很多,就是为了能够搭上AAV这条船进行成体体内的基因编辑
结语
病毒载体的构想和发明无疑是合成生物史上华丽的一笔,谁能想到,在几百年前让无数医生抓狂的看不见、摸不到的小玩意,能够在今天成为人们钻开细胞屏障,触及DNA的如意法宝。如今已经学习了那么多实验,我还是能记得刚看到这个设计的那时给我带来的震撼感觉。
特别推荐:Viral Vectors 101: Viral Vector Elements
主要参考:
[^1]: Mann, R., Mulligan, R.C., Baltimore, D., 1983. Construction of a retrovirus packaging mutant and its use to produce helper-free defective retrovirus. Cell 33, 153–159. https://doi.org/10.1016/0092-8674(83)90344-6
[^2]: Temin, H.M., n.d. RETROVIR(JS VECTORS FOR GENE TRANSFER: EFFICIENT INTEGRATION INTO AND EXPRESSION OF EXOGENO(JS DNA IN VERTEBRATE CELL GENOMES.
[^3]: 病毒载体101:假型 — Viral Vectors 101: Pseudotyping
[^4]: Tandon, N., Thakkar, K., LaGory, E., Liu, Y., Giaccia, A., 2018. (二代慢病毒转染)Generation of Stable Expression Mammalian Cell Lines Using Lentivirus. BIO-PROTOCOL 8. https://doi.org/10.21769/BioProtoc.3073
[^5]: Addgene:腺病毒指南 — Addgene: Adenovirus Guide
[^6]: Viral Vectors 101: An Introduction to AAV
[^7]: Li, C., Samulski, R.J., 2020. Engineering adeno-associated virus vectors for gene therapy. Nat Rev Genet 21, 255–272. https://doi.org/10.1038/s41576-019-0205-4